모두가 양돈 현장에서 PRRS를 여러 차례 겪어 봤지만, 아직도 PRRS 컨트롤에 대한 '정답'은 없습니다. 오랜 기간 양돈농가를 괴롭혀온 만큼 PRRS에 대한 오해와 편견이 많이 쌓여있는 현실입니다. 'PRRS의 모든 지식'(총 15화)을 통해 우리 농장에 맞는 PRRS 컨트롤의 '해답'을 발견할 수 있길 기대합니다. 본 기고글은 HIPRA 본사에서 출간한 'The book for PRRS Knowledge"' 내용을 번역·정리한 것입니다.

2화 PRRS는 어떻게 감염되어 증상을 유발할까?
PRRS 바이러스는 어떻게 돼지에게 감염되고 질병을 일으킬까?
PRRS 바이러스는 돼지 전신의 모든 세포에서 증식할 수 없습니다. PRRS 바이러스는 폐의 일부 대식세포, 태반, 림프 기관 등 일부 조직 및 세포에서만 증식할 수 있는 제한적인 친화성을 가진 바이러스입니다. 최근 연구에서는 PRRS 바이러스가 골수나 단핵구 유래의 수지상 세포에도 감염되어 증식할 수 있다고 보고되고 있습니다. 하지만 단핵구, 복강대식세포, 골수간세포, 형질세포양 수지상세포 등 다른 면역세포 및 줄기세포들을 감염시킬 수는 없으며, 여전히 제한적인 세포에만 감염성이 있다고 볼 수 있습니다.
왜 돼지의 특정 세포에서만 PRRS 바이러스가 증식할까?
그렇다면 왜 특정 세포에서만 PRRS 바이러스 감염이 일어날 수 있을까요? 그 이유는 PRRS 바이러스의 감염을 돕는 세포의 수용체에서 찾아볼 수 있습니다. PRRS 바이러스에 대한 잠재적인 세포 수용체로는 6가지가 알려져 있습니다: (1) 헤파란 황산염(heparan sulfate, 동물세포의 생물학적 활성을 조절하는 선형 다당류), (2) 비멘틴(vimentin, 세포의 구조 단백질로 기능하는 필라멘트 단백질), (3) CD151(CD; Cluster of Differentiation, 특정 항체 집단에 인식되는 세포의 표면 분화 항원), (4) CD163, (5) CD169(poSn, Porcine sialoadhesin), (6) CD209(DC-SIGN). 여기에 가장 많이 알려진 CD169(poSn)과 CD163은 대식세포에서만 발현되는 것이 특징입니다. 현재까지 연구에 따르면 CD163은 PRRS 바이러스에 대한 가장 주요한 수용체로 바이러스의 내부로 들어가고 분리되어 나오는 과정에 모두 관여하는 것으로 알려져 있습니다. 이러한 수용체 연구에서 착안하여 돼지에서 CD163 발현 유전자를 제거해 PRRS 감염 저항성 돼지를 개발하는 연구도 이뤄졌습니다.
폐는 PRRS 바이러스가 침투할 수 있는 대식세포가 다수 분포하는 기관입니다. 많은 감염 케이스에서 PRRS 바이러스는 감염 초기에 폐의 국소세포에서 증식을 시작합니다. 이후 바이러스는 수시간(6-12시간) 이내에 혈액에서 검출되기 시작하는데, 감염 후 일주일 정도 뒤에는 검출되는 양이 최대치에 이릅니다. 이러한 바이러스혈증(viremia)의 지속 기간은 바이러스주(strain) 및 감염 돼지의 일령에 따라 크게 달라집니다. 예를 들어, 어린 자돈에서는 바이러스혈증이 몇 주간 지속될 수 있는 반면, 성돈에서는 불과 며칠 이내에 종료됩니다.
바이러스 감염기간이 경과되면서 PRRS 바이러스는 편도나 림프절 등 면역 기관으로 퍼져 나가고, 때로는 '림프-혈액 통로(lympho-hematic way)'를 통해 여러 조직으로 이동하기도 합니다. 바이러스혈증 단계가 끝난 이후에도 PRRS 바이러스는 천천히 증식하며, 2차 림프 기관들에 오랫동안 잔존하게 됩니다. 처음 감염된 후 157일이 경과한 개체에서 분리된 PRRS 바이러스에서 여전히 감염성이 확인되거나, 감염 후 251일이 경과한 시점까지도 항원이 검출된 사례 등은 PRRS 바이러스가 돼지의 체내에 매우 장기간 잔존할 수 있다는 증거입니다. PRRS 바이러스에 감염된 채 태어난 자돈은 생후 112일령이 지난 후에도 음성 돼지를 감염시킬 수 있다는 연구 결과도 있습니다.
어떻게 PRRS 바이러스는 감염돈에 장기간 존재할까?
PRRS 바이러스가 이처럼 오랫동안 돼지에 잔존할 수 있는 이유가 무엇인지는 아직 명확하게 규명되지 않았습니다. 다만 이에 대한 가설로 준종 바이러스(qausispecies, 변이가 매우 활발한 RNA 바이러스의 유사 변종 유전자 집단. 일명 ‘변종 구름, mutant clouds’라고도 함) 내에서 돼지의 면역 반응을 회피할 수 있는 종으로 PRRS가 선택된다는 추측이 있습니다. 이러한 선택과정을 통해 돼지의 면역을 회피하는 PRRS 바이러스가 남아 장기간 지속된다는 이론입니다.

폐에서 PRRS 바이러스가 가장 활발하게 증식할 수 있는 세포는 '폐포대식세포(pulmonary alveolar macrophage)'와 '폐혈관내대식세포(pulmonary intravascular macrophage)'입니다. PRRS 바이러스는 폐에서 증식하면서 염증세포들을 침윤시켜 간질성 폐렴(interstitial pneumonia)을 유발하고 기능을 약화시킵니다. 간질성 폐렴은 PRRS 바이러스 감염 시 볼 수 있는 흔한 병변이지만, 다른 질병 감염시에도 쉽게 볼 수 있는 비특이적인 병변입니다.
PRRS 바이러스 감염에 의한 임상증상과 병변은 다양한 메커니즘에 의해 일어나며, 이는 기본적으로 아래의 영향에 의해 이뤄집니다.
▶ 감염된 대식세포뿐 아니라 감염되지 않은 대식세포도 사멸시킴
▶ 다클론항체를 생성하는 B세포 활성화하고 염증성 사이토카인 분비를 유도함
PRRS 바이러스가 '돼지 호흡기질병 복합 감염증(PRDC, porcine respiratory disease complex)'의 선행요인으로 복합적인 형태의 증상으로 발전하면, 농장에서는 PRRS 문제를 파악하기 더욱 어려워집니다. 실제 PRDC의 임상 사례를 분석했을 때 가장 많이 분리되는가 바로 PRRS 바이러스이기도 합니다. PRRS 바이러스가 다른 바이러스나 세균의 복합감염에 영향을 미치고 있다는 사실은 여러 연구들을 통해 입증되어 왔습니다.
PRRS 바이러스 감염에 의한 임상증상

PRRS에 의한 번식장애는 왜 임신 후기에 주로 발생할까?
PRRS에 의한 번식장애는 임신 후반부로 갈수록 임상증상의 심각도가 높아지는 특성을 보여줍니다. 반대로 임신 초기에 PRRS에 의한 재발이나 유산은 연관관계를 찾아보기가 어렵습니다. 이는 PRRS 바이러스를 받아들이는 태반 및 태아 대식세포의 수용체가 임신기간이 경과될수록 증가하는 경향을 보이기 때문입니다. 여기에서 PRRS 바이러스가 감염된 대식세포를 통해 가장 효과적으로 태반 장벽을 통과할 수 있는 시기가 바로 임신 후기(임신85일 전후)에 시작됩니다. 태아는 모돈으로부터 직접 바이러스를 전달받아 감염되기도 하지만, 먼저 감염된 다른 태아로 인해 감염될 수도 있습니다.
과거 연구 초기에는 PRRS 바이러스에 의한 태아의 문제가 바이러스에 직접적으로 감염되어서 일어나는 것이 아니라, 태반의 '모돈-태아 접촉면(maternal fetal interface)'에 발생한 영향으로 나타난 결과라고 여겨왔습니다. 하지만 최근 연구를 통해 태아 조직에서의 PRRS 바이러스 증식과 인접한 태아로부터의 바이러스 전파감염이 태아에 중대한 영향을 미치고 있다는 것이 밝혀졌습니다. 이러한 방식으로 PRRS 바이러스는 임신돈에 유산을 유발하는 것은 물론 태아들의 활력에 영향을 미치고 조산을 일으킬 수 있습니다.
PRRS에 의한 증상은 왜 농장마다 다를까?
PRRS 임상 증상의 심각도는 1) PRRS 바이러스 주(strain)가 가진 특유의 병원성, 2) 돈군의 면역 수준, 3) 감염 돼지의 일령 및 모돈의 번식 단계, 4) 다른 병원체와의 혼합 감염 여부 등에 따라서 다양한 수준으로 나타날 수 있습니다. PRRS 음성 농장에서 문제가 발생하는 경우 보통 하나 이상의 생산 구간에서 시작되며, 첫 2주간 식욕부진, 발열, 허탈 등의 증상이 여러 일령의 돼지에서 나타나게 됩니다. 대부분의 모돈들이 감염 3-21일 후 유산을 하게 되며, 이 양상은 수개월 간 지속될 수 있습니다.
이어지는 내용은 PRRS의 임상 증상들을 요약한 것입니다. (※주의: 감염된 돼지 모두에서 임상 증상이 나타나는 것은 아닙니다. 또한 같은 발생기간 동안에 모든 돼지에서 증상을 보이는 것도 아닙니다.)


새로운 위협, 고병원성 PRRS 바이러스
감염된 돼지에서 PRRS 바이러스를 분리할 때 확인되는 한 가지 중요한 사실은 PRRS 바이러스 분리주에 따라 증식 속도가 다르고 각각 다른 조직에서 검출될 수 있다는 것입니다. 이것은 PRRS 바이러스 주(strain)에 따라 증식력, 병원성, 전파력이 다양하다는 것을 암시합니다.
2006년 6월에서 9월까지, 중국에서 이례적인 유형의 PRRS가 발생하여 2백만 두 이상의 돼지가 감염되고, 이중 40만 마리가 폐사했습니다. 이때부터 고병원성 PRRS주(HP-PRRSV strain, highly-pathogenic PRRS virus strain)이 아시아 지역에 퍼지기 시작했습니다. HP-PRRSV는 이전의 PRRS 발병과 다르게, 이 유형의 PRRS 바이러스는 병원성 매우 강력하기 때문에 따로 분류하여 연구되고 있습니다.
HP-PRRS 바이러스에 의한 증상의 범위 또한 기존의 PRRS 바이러스보다 더 폭넓은 것으로 보이며 신장, 간, 비장도 영향을 받는 것으로 알려져 있습니다. 증상의 심각도 역시 더 높게 나타나 감염 시 임신돈의 유산율이 50%까지 보고되었으며, 성돈에서도 10% 이상의 높은 폐사율을 유발하는 것으로 보고되었습니다. 이처럼 PRRS 바이러스는 지속적으로 진화하고 있고, 여전히 국가마다 다양한 형태로 나타나는 양돈 산업의 진행중인 위험요소입니다.
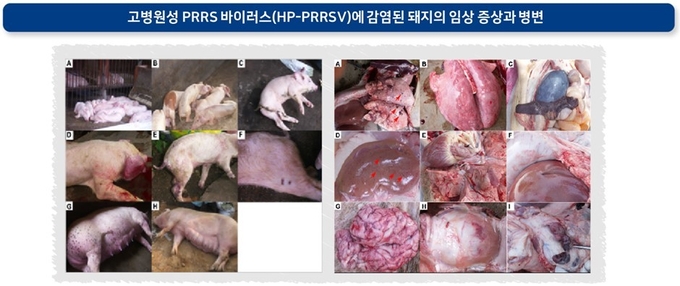
▶ 사진 왼쪽: A) 겉으로는 통통하고 건강하게 보이는 환돈. B) 마르고 위축된 환돈. C) 몸을 떠는 자돈. D) 귀에 홍반성 발진을 보이며 다리를 절뚝이는 환돈. E) & F) 감염 돼지의 등에 발생하는 여드름 형태의 피부 병변. G) & H) 발병 기간에 폐사한 성돈
▶ 사진 오른쪽: A) 폐의 출혈(화살표). B) 폐 부종. C) 비장 경색과 적갈색 오줌으로 채워진 팽창한 방광. D) 신장의 점상 출혈(화살표). E) 순환 장애가 발생한 심장. F) 출혈 및 황색 또는 흰색의 괴사소가 발생한 간. G) 경도의 뇌연화증. H) 혈액이 빠져나간 대뇌 피각(렌즈핵의 외측부). I) 림프절의 출혈점
참고 문헌
- Allan GM, McNeilly F, Ellis J, Krakowka S, Meehan B, McNair I, Walker I, Kennedy S. Experimental infection of colostrum deprived piglets with porcine circovirus 2 (PCV2) and porcine reproductive and respiratory syndrome virus (PRRSV) potentiates PCV2 replication. Arch Virol. 2000, 145:2421-9.
- Baron T, Albina E, Leforban Y, Madec F, Guilmoto H, Plana Duran J, Vannier P. Report on the first outbreaks of the porcine reproductive and respiratory syndrome (PRRS) in France. Diagnosis and viral isolation. Ann Rech Vet. 1992, 23:161-6.
- Benfield DA, Nelson E, Collins JE, Harris L, Hennings JC, Shaw DP, Goyal SM, McCullough S, Morrison RB, Joo HS, Gorcyca D, Chladek D. Characterization of swine infertility and respiratory syndrome (SIRS) virus (isolate ATCC VR-2332). J Vet Diagn Invest. 1992. 4, 127-133.
- Benfield D, Nelson J, Rossow K, Nelson C, Steffen M, Rowland R. Diagnosis of persistent or prolonged porcine reproductive and respiratory syndrome virus infections Vet Res. 2000, 31:71.
- Blaha T. The ”colorful” epidemiology of PRRS. Vet Res BioMed Central. 2000, 31:77-83.
- Brockmeier SL, Palmer MV, Bolin SR. Effects of intranasal inoculation of porcine reproductive and respiratory syndrome virus, Bordetella bronchiseptica, or a combination of both organisms in pigs. Am J Vet Res. 2000, 61:892-9.
- Carman S, Sanford SE, Dea S. Assessment of seropositivity to porcine reproductive and respiratory syndrome (PRRS) virus in swine herds in Ontario–1978 to 1982. Can Vet J. 1995, 36:776-7.
- Collins JE, Benfield DA, Christianson WT, Harris L, Hennings JC, Shaw DP, Goyal SM, McCullough S, Morrison RB, Joo HS, et al. Isolation of swine infertility and respiratory syndrome virus (isolate ATCC VR-2332) in North America and experimental reproduction of the disease in gnotobiotic pigs. J Vet Diagn Invest. 1992, 4:117-26.
- Cortey M, Díaz I, Martín-Valls GE, Mateu E. Next-generation sequencing as a tool for the study of Porcine reproductive and respiratory syndrome virus (PRRSV) macro- and micro- molecular epidemiology. Vet Microbiol. 2017. doi: 10.1016/j.vetmic.2017.02.002.
- Delrue I, Van Gorp H, Van Doorsselaere J, Delputte PL, Nauwynck HJ. Susceptible cell lines for the production of porcine reproductive and respiratory syndrome virus by stable transfection of sialoadhesin and CD163. BMC Biotechnol. 2010, 29:10:48.
- Díaz I, Darwich L, Pappaterra G, Pujols J, Mateu E. Different European-type vaccines against porcine reproductive and respiratory syndrome virus have different immunological properties and confer different protection to pigs. Virology. 2006, 351:249-59.
- Dobrescu I, Levast B, Lai K, Delgado-Ortega M, Walker S, Banman S, Townsend H, Simon G, Zhou Y, Gerdts V, Meurens F. In vitro and ex vivo analyses of co-infections with swine influenza and porcine reproductive and respiratory syndrome viruses. Vet Microbiol.2014, 169:18-32.
- Duan X, Nauwynck HJ, Pensaert MB. Virus quantification and identification of cellular targets in the lungs and lymphoid tissues of pigs at different time intervals after inoculation with porcine reproductive and respiratory syndrome virus (PRRSV). Vet Microbiol. 1997, 56:9-19.
- Fan P, Wei Y, Guo L, Wu H, Huang L, Liu J, Liu C. Synergistic effects of sequential infection with highly pathogenic porcine reproductive and respiratory syndrome virus and porcine circovirus type 2. Virol J.2013, 10:265.
- Forsberg R, Oleksiewicz MB, Petersen AM, Hein J, Bøtner A, Storgaard T. A molecular clock dates the common ancestor of European-type porcine reproductive and respiratory syndrome virus at more than 10 years before the emergence of disease. Virology. 2001, 289:174-9.
- Gómez-Laguna J, Salguero FJ, Pallarés FJ, Carrasco L. Immunopathogenesis of porcine reproductive and respiratory syndrome in the respiratory tract of pigs. Vet J. 2013, 195:148-55.
- Harms PA, Sorden SD, Halbur PG, Bolin SR, Lager KM, Morozov I, Paul PS. Experimental reproduction of severe disease in CD/CD pigs concurrently infected with type 2 porcine circovirus and porcine reproductive and respiratory syndrome virus. Vet Pathol. 2001, 38:528-39.
- He Q, Li Y, Zhou L, Ge X, Guo X, Yang H. Both Nsp1β and Nsp11 are responsible for differential TNF-α production induced by porcine reproductive and respiratory syndrome virus strains with different pathogenicity in vitro. Virus Res. 2015, 201:32-40.
- Hill H. Overview and history of Mystery Swine Disease (swine infertility/respiratory syndrome). Proceedings of the Mystery Swine Disease Committee Meeting, Livestock Conversation Institute, Denver, CO. 1990, 29–31.
- Hirose 0, Kudo H, Yoshizawa S, Hiroike T, Nakane T. Prevalence of porcine reproductive and respiratory syndrome virus in Chiba prefecture. J Jpn Vet Med Assoc. 1995, 48:650-3.
- Holtkamp DJ, Kliebenstein JB, Neumann EJ, Zimmerman JJ, Rotto HF, Yoder TK, Wang C, Yeske PE, Mowrer CL and Haley CA. Assessment of the economic impact of porcine reproductive and respiratory syndrome virus on United States pork producers. J Swine Health Prod. 2013, 21:72-84.
- Hirose O, Shibata I, Kudou H, Samegai Y, Yoshizawa S, Ono M, Nishimura M, Hiroike T, Kageyama K, Sakano T. Experimental infection of SPF piglets with porcine reproductive and respiratory syndrome (PRRS) viruses isolated from two farms. J Vet Med Sci. 1995, 57:991-5.
- Jung K, Renukaradhya GJ, Alekseev KP, Fang Y, Tang Y, Saif LJ. Porcine reproductive and respiratory syndrome virus modifies innate immunity and alters disease outcome in pigs subsequently infected with porcine respiratory coronavirus: implications for respiratory viral co-infections. J Gen Virol. 2009, 90:2713-23.
- Karniychuk UU, Nauwynck HJ. Quantitative changes of sialoadhesin and CD163 positive macrophages in the implantation sites and organs of porcine embryos/fetuses during gestation. Placenta. 2009, 30:497-500.
- Karniychuk UU, Geldhof M, Vanhee M, Van Doorsselaere J, Saveleva TA, Nauwynck HJ. Pathogenesis and antigenic characterization of a new East European subtype 3 porcine reproductive and respiratory syndrome virus isolate. BMC Vet Res. 2010, 4:6:30.
- Karniychuk UU, Nauwynck HJ. Pathogenesis and prevention of placental and transplacental porcine reproductive and respiratory syndrome virus infection. Vet Res. 2013, 44:95.
- Kavanová L, Matiašková K, Levá L, Štěpánová H, Nedbalcová K, Matiašovic J, Faldyna M, Salát J. Concurrent infection with porcine reproductive and respiratory syndrome virus and Haemophilus parasuis in two types of porcine macrophages: apoptosis, production of ROS and formation of multinucleated giant cells. Vet Res.2017, 48:28.
- Kitikoon P, Vincent AL, Jones KR, Nilubol D, Yu S, Janke BH, Thacker BJ, Thacker EL. Vaccine efficacy and immune response to swine influenza virus challenge in pigs infected with porcine reproductive and respiratory syndrome virus at the time of SIV vaccination. Vet Microbiol. 2009, 139:235-44.
- Keffaber KK. Reproductive failure of unknown etiology. AASP. 1989, 1: 2–10.
- Lawson SR, Rossow KD, Collins JE, Benfield DA, Rowland RR. Porcine reproductive and respiratory syndrome virus infection of gnotobiotic pigs: sites of virus replication and co-localization with MAC-387 staining at 21 days post-infection. Virus Res. 1997, 51:105-13.
- Leng X, Li Z, Xia M, Li X, Wang F, Wang W, Zhang X, Wu H. Mutations in the genome of the highly pathogenic porcine reproductive and respiratory syndrome virus potentially related to attenuation. Vet Microbiol. 2012, 157:50-60.
- Li Y, Zhou L, Zhang J, Ge X, Zhou R, Zheng H, Geng G, Guo X, Yang H. Nsp9 and Nsp10 contribute to the fatal virulence of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China. PLoS Pathog. 2014, 10(7):e1004216.
- Li J, Wang S, Li C, Wang C, Liu Y, Wang G, He X, Hu L, Liu Y, Cui M, Bi C, Shao Z, Wang X, Xiong T, Cai X, Huang L, Weng C. Secondary Haemophilus parasuis infection enhances highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV) infection-mediated inflammatory responses. Vet Microbiol.2017, 204:35-42.
- Lindhaus W, Lindhaus B. Raetselhafte Schweinekrankheit. Prakt Tierarzt 1991, 5:423–5
- Loula T. Mystery pig disease. Agri-practice. 1991, 12:23–34.
- Loving CL, Brockmeier SL, Sacco RE. Differential type I interferon activation and susceptibility of dendritic cell populations to porcine arterivirus. Immunology. 2007, 120:217-29.
- Lu W, Sun B, Mo J, Zeng X, Zhang G, Wang L, Zhou Q, Zhu L, Li Z, Xie Q, Bi Y, Ma J. Attenuation and immunogenicity of a live high pathogenic PRRSV vaccine candidate with a 32-amino acid deletion in the nsp2 protein. J Immunol Res. 2014, 2014:810523.
- Lunney JK, Benfield DA, Rowland RR.Porcine reproductive and respiratory syndrome virus: an update on an emerging and re-emerging viral disease of swine. Virus Res. 2010, 154:1-6.
- Mardassi H, Massie B, Dea S. Intracellular synthesis, processing, and transport of proteins encoded by ORFs 5 to 7 of porcine reproductive and respiratory syndrome virus. Virology. 1996, 221:98-112.
- Martínez-Lobo FJ, Díez-Fuertes F, Segalés J, García-Artiga C, Simarro I, Castro JM, Prieto C. Comparative pathogenicity of type 1 and type 2 isolates of porcine reproductive and respiratory syndrome virus (PRRSV) in a young pig infection model. Vet Microbiol. 2011, 154:58-68.
- Mateu E, Diaz I. The challenge of PRRS immunology. Vet J. 2008, 177:345-51.
- Meng XJ, Paul PS, Halbur PG. Molecular cloning and nucleotide sequencing of the 3′-terminal genomic RNA of the porcine reproductive and respiratory syndrome virus. J Gen Virol. 1994, 75:1795-801.
- Meng XJ, Paul PS, Halbur PG, Lum MA. Phylogenetic analyses of the putative M (ORF 6) and N (ORF 7) genes of porcine reproductive and respiratory syndrome virus (PRRSV): implication for the existence of two genotypes of PRRSV in the U.S.A. and Europe. Arch Virol. 1995, 140:745-55.
- Meredith MJ. Review of porcine reproductive and respiratory syndrome. Pig Disease Information Centre, University of Cambridge, Cambridge, England. 1-24.
- Meulenberg JJ, Hulst MM, de Meijer EJ, Moonen PL, den Besten A, de Kluyver EP, Wensvoort G, Moormann RJ. Lelystad virus, the causative agent of porcine epidemic abortion and respiratory syndrome (PEARS), is related to LDV and EAV. Virology. 1993, 192:62-72.
- Meulenberg JJ, Hulst MM, de Meijer EJ, Moonen PL, den Besten A, de Kluyver EP, Wensvoort G, Moormann RJ. Lelystad virus belongs to a new virus family, comprising lactate dehydrogenase-elevating virus, equine arteritis virus, and simian hemorrhagic fever virus. Arch Virol Suppl. 1994, 9:441-8.
- Meulenberg JJ, Petersen-den Besten A, De Kluyver EP, Moormann RJ, Schaaper WM, Wensvoort G. Characterization of proteins encoded by ORFs 2 to 7 of Lelystad virus. Virology. 1995, 206:155-63.
- Morin M, Carpenter J, Poljack Z, Rivest J, Urizar L, Klopfenstein C, PRRS economic impact simulation tool for regional control and eradication projects in Canada. 2014 IPVS Congress. p 220.
- Murtaugh MP1, Elam MR, Kakach LT. Comparison of the structural protein coding sequences of the VR-2332 and Lelystad virus strains of the PRRS virus. Arch Virol. 1995, 140:1451-60.
- Murtaugh MP, Stadejek T, Abrahante JE, Lam TT, Leung FC. The ever-expanding diversity of porcine reproductive and respiratory syndrome virus. Virus Res. 2010, 154:18-30.
- Nauwynck HJ, Van Gorp H, Vanhee M, Karniychuk U, Geldhof M, Cao A, Verbeeck M, Van Breedam W. Micro-dissecting the pathogenesis and immune response of PRRSV infection paves the way for more efficient PRRSV vaccines. Transbound Emerg Dis. 2012, 59 Suppl 1:50-4.
- Nelson EA, Christopher-Hennings J, Drew T, Wensvoort G, Collins JE, Benfield DA. Differentiation of U.S. and European isolates of porcine reproductive and respiratory syndrome virus by monoclonal antibodies. J Clin Microbiol. 1993, 31:3184-9.
- Neumann EJ, Kliebenstein JB, Johnson CD, Mabry JW, Bush EJ, Seitzinger AH, Green AL, Zimmerman JJ. Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States. J Am Vet Med Assoc. 2005, 227:385-92.
- Nieuwenhuis N, Duinhof TF, van Nes A. Economic analysis of outbreaks of porcine reproductive and respiratory syndrome virus in nine sow herds. Vet Rec. 2012, 170:225.
- Ohlinger V.F., Pesch S., Bischoff C., History, occurrence, dynamics and current status of PRRS in Europe, Vet Res. 2000, 31: 86-87.
- World Organisation for Animal Health; World Animal Health Information Database Interface; OIE 2013.
- Pirtle EC, Beran GW. Stability of porcine reproductive and respiratory syndrome virus in the presence of fomites commonly found on farms. J Am Vet Med Assoc. 1996, 208:390-2. Plagemann PG. Porcine reproductive and respiratory syndrome virus: origin hypothesis. Emerg Infect Dis. 2003, 9:903-8.
- Plagemann PG. Lactate dehydrogenase-elevating virus and related viruses. In: Fields Virology, 3rd ed. Ed. Fields BN, Knipe DM, Howley PM, et al. 1105-20.
- Plana J, Vayreda M, Vilarrasa J, Bastons M, Rosell R, Martinez M, San Gabriel A, Pujols J, Badiola JL, Ramos JA, et al. Porcine epidemic abortion and respiratory syndrome (mystery swine disease). Isolation in Spain of the causative agent and experimental reproduction of the disease. Vet Microbiol. 1992, 33:203-11.
- Pol JM, van Leengoed LA, Stockhofe N, Kok G, Wensvoort G. Dual infections of PRRSV/influenza or PRRSV/Actinobacillus pleuropneumoniae in the respiratory tract. Vet Microbiol. 1997, 55:259-64.
- Reiner G. Genetic resistance – an alternative for controlling PRRS? Porcine Health Management 2016, 2:27.
- Renukaradhya GJ, Alekseev K, Jung K, Fang Y, Saif LJ. Porcine reproductive and respiratory syndrome virus-induced immunosuppression exacerbates the inflammatory response to porcine respiratory coronavirus in pigs. Viral Immunol. 2010, 23:457-66.
- Salines M, Barnaud E, Andraud M, Eono F, Renson P, Bourry O, Pavio N, Rose N. Hepatitis E virus chronic infection of swine co-infected with Porcine Reproductive and Respiratory Syndrome Virus. Vet Res.2015, 6;46:55. Shibata I, Yazawa S, Ono M, Okuda Y. Experimental dual infection of specific pathogen-free pigs with porcine reproductive and respiratory syndrome virus and pseudorabies virus. J Vet Med B Infect Dis Vet Public Health. 2003, 50:14-9.
- Shin JH, Kang YB, Kim YJ, Yeom SH, Kweon CH, Lee WY, Jean YH, Hwang EK, Rhee JC, An SH, Cho IS, Oh JS, Joo HS, Choi CS, Molitor TW. Sero-epidemiological studies on porcine reproductive and respiratory syndrome in Korea. I. Detection of indirect fluorescent antibodies. RDA J Agri Sci. 1993, 35: 572-6.
- SIP Consultors. Repercusión económica del PRRS. Lleida, Spain. 2013.
- Snijder EJ, Kikkert M, Fang Y. Arterivirus molecular biology and pathogenesis. J Gen Virol. 2013, 94:2141-63.
- Solano GI, Segalés J, Collins JE, Molitor TW, Pijoan C. Porcine reproductive and respiratory syndrome virus (PRRSv) interaction with Haemophilus parasuis. Vet Microbiol. 1997, 55:247-57.
- Solano GI, Bautista E, Molitor TW, Segales J, Pijoan C. Effect of porcine reproductive and respiratory syndrome virus infection on the clearance of Haemophilus parasuis by porcine alveolar macrophages. Can J Vet Res. 1998, 62:251-6.
- Stadejek T. Explore unexplored: origin of PRRSV revealed? In Proceedings of the European, Middle Eastern and Africa Society for Biopreservation and Biobanking (ESBB) conference. November 16-19. France.
- Thacker EL, Halbur PG, Ross RF, Thanawongnuwech R, Thacker BJ. Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. J Clin Microbiol. 1999, 37:620-7.
- Thacker EL, Thacker BJ, Young TF, Halbur PG. Effect of vaccination on the potentiation of porcine reproductive and respiratory syndrome virus (PRRSV)-induced pneumonia by Mycoplasma hyopneumoniae. Vaccine. 2000, 18:1244-52.
- Thanawongnuwech R, Brown GB, Halbur PG, Roth JA, Royer RL, Thacker BJ. Pathogenesis of porcine reproductive and respiratory syndrome virus-induced increase in susceptibility to Streptococcus suis infection. Vet Pathol. 2000, 37: 143-52.
- ThanawongnuwechR, Thacker B, Halbur P, Thacker EL. Increased production of proinflammatory cytokines following infection with porcine reproductive and respiratory syndrome virus and Mycoplasma hyopneumoniae. Clin Diagn Lab Immunol. 2004, 11: 901-8.Thanawongnuwech R, Thacker EL, Halbur PG. Effect of Porcine reproductive and respiratory syndrome virus (PRRSV) (isolate ATCC VR-2385) infection on bactericidal activity of porcine pulmonary intravascular macrophages (PIMs): In vitro comparisons with pulmonary alveolar macrophages (PAMs). Vet Immunol Immunopathol. 1997, 59:323-335.
- Terpstra C, Wensvoort G, Pol JM. Experimental reproduction of porcine epidemic abortion and respiratory syndrome (mystery swine disease) by infection with Lelystad virus: Koch’s postulates fulfilled. Vet Q. 1991, 13:131-6.
- Tian K, Yu X, Zhao T, Feng Y, Cao Z, Wang C, Hu Y, Chen X, Hu D, Tian X, Liu D, Zhang S, Deng X, Ding Y, Yang L, Zhang Y, Xiao H, Qiao M, Wang B, Hou L, Wang X, Yang X, Kang L, Sun M, Jin P, Wang S, Kitamura Y, Yan J, Gao GF. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark. PLoS One. 200, 2:e526.
- Van der Linden IF, Voermans JJ, van der Linde-Bril EM, Bianchi AT, Steverink PJ. Virological kinetics and immunological responses to a porcine reproductive and respiratory syndrome virus infection of pigs at different ages. Vaccine. 2003, 21:1952-7.
- Van Gorp H, Van Breedam W, Delputte PL, Nauwynck HJ. Sialoadhesin and CD163 join forces during entry of the porcine reproductive and respiratory syndrome virus. J Gen Virol. 2008, 89:2943-53.
- Wang G, Song T, Yu Y, Liu Y, Shi W, Wang S, Rong F, Dong J, Liu H, Cai X, Zhou EM. Immune responses in piglets infected with highly pathogenic porcine reproductive and respiratory syndrome virus. Vet Immunol Immunopathol. 2011, 142:170-8.
- Wensvoort G, Terpstra C, Pol JMA, Lask EA, Bloemraad M, de Kluyver EP, Kragten C, van Butten L, den Besten A, Wagenaar F, Broekhuijsen JM, Moonen PJM, Zetstra T, de Boer EA, Tibben AhJ, de Jong MF, van’r Veld P, Groenland GJR, van Gennep JA, Voets MTh, Verheijden JHM, Braamkamp J. Mystery swine disease in the Netherlands: the isolation of Lelystad virus. Vet Q. 1991, 13:121–30.
- Wesley RD, Mengeling WL, Lager KM. Prior infection of nursery-age pigs with porcine reproductive and respiratory syndrome virus does not affect the outcome of transmissible gastroenteritis virus challenge. J Vet Diagn Invest. 1998, 10:221-8.
- White M. Blue ear disease of pigs. Vet Rec. 1991, 128:574.
- White M. The clinical signs and symptoms of “blue eared pig disease”. Pig Vet J. 1991, 28:62-8.
- Wills RW, Gray JT, Fedorka-Cray PJ, Yoon KJ, Ladely S, Zimmerman JJ. Synergism between porcine reproductive and respiratory syndrome virus (PRRSV) and Salmonella choleraesuis in swine. Vet Microbiol. 2000, 71:177-92.
- pig333.com/prrs/prrsv-infection-in-france-clinical-and-economic-impact_9563/
- thepigsite.com/articles/4490/danish-pig-research-centreannual-report-2012-prrs
- Yamane I, Kure K, Ishikawa H, Takagi M, Miyazaki A, Suzuki T, Shibahara T, Kubo M, Kobayashi H, Kokuho T, Tsunemitsu H. Estimation of economic loss due to porcine reproductive and respiratory syndrome in Japan.
- Yu J, Wu J, Zhang Y, Guo L, Cong X, Du Y, Li J, Sun W, Shi J, Peng J, Yin F, Wang D, Zhao P, Wang J. Concurrent highly pathogenic porcine reproductive and respiratory syndrome virus infection accelerates Haemophilus parasuis infection in conventional pigs. Vet Microbiol.2012, 158:316-21.
- Yun SI, Lee YM. Overview: Replication of porcine reproductive and respiratory syndrome virus. J Microbiol. 2013, 51:711-23.
- Zhang Q, Yoo D. PRRS virus receptors and their role for pathogenesis. Vet Microbiol. 2015, 177:229-41.
- Zimmerman J, Yoon K-J, Wills RW, Swenson SL. General overview of PRRSV: A perspective from the United States. Vet Microbiol. 1997, 55:187-96.
- Zhou Z, Ni J, Cao Z, Han X, Xia Y, Zi Z, Ning K, Liu Q, Cai L, Qiu P, Deng X, Hu D, Zhang Q, Fan Y, Wu J, Wang L, Zhang M, Yu X, Zhai X, Tian K. The epidemic status and genetic diversity of 14 highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV) isolates from China in 2009. Vet Microbiol. 2011, 150:257-69.
- Zimmerman JJ, Benfield DA, Dee SA, Murtaugh MP, Stadejek T, Stevenson GW, Torremorell M. Porcine reproductive and respiratory syndrome virus (porcine arterivirus). In: 10th ed. Diseases of swine, Ed. Wiley-Blackwell. 2012, 31:463-86.