
신경증상과 설사를 유발하는 병원체로 알려진 '돼지 아스트로바이러스'가 호흡기 질병도 유발할 수 있는 것으로 밝혀졌습니다. 노스캐롤라이나 주립대학교, USDA 농업연구소, 아이오와 주립대학교, 캘리포니아 대학교 산타크루즈의 공동 연구팀은 '돼지 건강 정보 센터(Swine health information center)'의 자금 지원을 받아 '돼지 아스트로바이러스 4형(porcine astrovirus 4, 이하 PoAstV4)' 단독으로 호흡기 질환을 일으킬 수 있는지 확인하기 위한 연구를 실시했습니다. PoAstV4 미감염 새끼 돼지(CDCD)를 바이러스에 감염시키고 그로 인한 감염과 병리학적 병변을 특성화하는 것이 포함되었습니다. 연구 결과 감염된 새끼 돼지는 분비물로 바이러스를 배출하고, 기관염과 기관지염을 나타냈고 조직에서 바이러스가 검출되었으며,, 감염에 대한 생산적인 면역 반응(IgM 및 IgG 검출)을 보였습니다. 이번 연구의 결과는 PoAstV4가 새끼 돼지의 호흡기에서 상피친화성 바이러스 감염의 주요 원인이 될 수 있음을 확인한 최초의 연구입니다. PoAstV4가 어린 돼지에서 기관염과 기관지염을 유발할 수 있는 주요 호흡기 병원체임을 뒷받침하

최근에 아스트로바이러스(AstVs)와 관련된 신경계 질환이 돼지, 반추동물, 밍크, 인간에서 보고되었다. 2017년 헝가리와 미국에서 뇌척수염을 보이는 돼지의 중추신경계(CNS)에서 신경침습성 돼지 아스트로바이러스(Ni-PAstV) 3형이 검출되었다. 국내 돼지에서 신경학적 증상을 보이는 개체들을 진단하는 과정에서, 화농성 뇌척수염과 뇌막염, 신경세포의 빈혈구화, 신경교증(Gliosis)를 특징으로 하는 조직병리학적 소견이 관찰되었으며, 2020년 8월부터 9월까지 한국 내 3개 농장(정읍, 함양 소재)에서 채취된 4마리의 돼지(4~8주령) CNS 샘플에서 '역전사 중합효소 연쇄반응(RT-PCR)'을 통해 PAstV가 확인되었다. 이후 3개의 뇌 샘플에서 ORF2 부위(region)가 성공적으로 분리되어 후속 분석이 가능해졌다. PAstV의 4가지 유전형(PAstV1, 3, 4, 5)이 검출되었으며, 뇌 샘플에서 PAstV의 다중 유전형 동시 감염이 관찰되었다. 이는 한국에서 돼지에서 Ni-PAstV 감염을 보고한 첫 번째 연구이다. [논문 원문(바로보기), Porcine Astrovirus Infection in Brains of Pigs in Korea,

'인플루엔자 A 바이러스(IAV)'는 사람과 돼지를 포함한 다양한 조류 및 포유류 숙주에서 전신 합병증을 동반한 호흡기 질환을 유발한다. 갓 태어난 동물에서 IAV 감염은 이 기간에 발생하는 빠른 발달 과정을 방해한다는 점에서 특히 위험할 수 있다. 모체에 대한 IAV 백신 접종은 후대의 IAV 감염 위험을 줄일 수 있지만, 모체로부터 전달된 항-IAV 항체가 감염 후 합병증을 예방하는지 여부는 알려지지 않았다. 본 연구에서는 모돈 백신 접종이 신생자돈에서의 인플루엔자 A 바이러스 감염 시 장 및 비강 미생물군집 발달과 해마 전사체에 미치는 영향을 평가했다. 모돈은 임신 70일과 90일에 실험용 인플루엔자 A 백신으로 접종하거나 PBS로 가짜 접종(mock-vaccinated)을 받았다. 백신 접종 및 미접종(PBS) 모돈에서 출생한 자돈은 분만 후 6일에 병원성 IAV 분리주에 노출되거나 PBS로 모의 노출된 후, 노출 후 5일에 안락사되었다. 백신 접종은 자돈의 폐 손상과 감염성 바이러스 부하를 유의미하게 감소시켰다. 비강 및 장내 미생물 군집 발달도 바이러스 교란으로부터 부분적으로 보호되었으며, 이는 비백신 접종 모돈의 자돈에 비해 노출 전 시점과의 편

'PED 바이러스(PEDV)'는 다양한 정도의 독성을 특징으로 하는 G1( G1a, G1b), G2(G2a, G2b) 및 S-INDEL로 나눈다. 대부분의 중국 PEDV 균주는 2011~2016년에 G2a 하위 그룹에 속했으며 2017~2019년에 G2b 하위 그룹으로 진화했다. 최근 중국에서 발생한 PED의 광범위한 발병은 고병원성 PEDV 변이(G2c)와 관련이 있었다. 2020년에서 2023년 사이, 장시성, 산둥성, 톈진 지역의 여러 돼지 농장에서 포유자돈에게 100% 이환율을 보이는 심각한 PED 발병이 관찰되었고, 이는 즉시 전국으로 확산되었다. 일부 농장에서는 불활성화 및 약독화 PEDV 백신이 널리 사용되었지만, 백신 접종을 받은 돼지 무리에서도 거의 100%의 폐사율을 보이는 PED 발병이 여전히 발생했다. 톈진 지역에서 채집한 5일령 돼지의 장 검체에서 실시간 PCR 검사를 통해 PEDV 양성이 확인되었다. 바이러스 분리 절차를 진행했다. 그 결과 S 유전자에 독특한 aa 돌연변이를 가진 새로운 중국 유전형 G2c PEDV 균주 'TJbc2023'을 분리했다. TJbc2023은 고병원성 균주였으며, 생후 3일령 자돈에서 심각한 장 질환을 유

전 세계적으로, 적어도 한국에서는 매년 모든 돼지에게 백신을 접종하는 지속적인 백신 접종 프로그램이 진행 중이지만, 'PED 바이러스(PEDV)'와 관련하여 아직 명확하게 밝혀지지 않은 많은 문제들이 있다. PED 역학 연구에서 이전에 PED 발병을 경험했던 농장에서 반복적인 발병이 매우 흔하게 발생한다. PEDV의 전파 경로는 여러 가지가 보고되었으며, 그 중에서도 감염된 분변과의 직접 접촉이 주요 전파원일 가능성이 있다. 본 연구의 목적은 PEDV의 수직 전파에 대한 증거를 찾는 것이다. 현재까지 알려진 바로는, 태반을 통한 PEDV의 수직 전파에 대한 과학적 결과를 제시한 최초의 연구이다. 분자 및 면역학적 분석을 통해 새끼 돼지의 고환 조직과 PEDV 양성 모돈의 탯줄에서 PEDV를 발견했다. 또한, 탯줄에서 PEDV를 성공적으로 분리했습니다. 이러한 결과는 PEDV가 모돈에서 새끼 돼지로 수직 전파된다는 것을 강력하게 뒷받침한다. 본 연구 결과를 보완하기 위한 추가 연구가 필요하지만, 적어도 PEDV 확산은 예상보다 훨씬 다양한 경로를 통해 이루어지고 있음을 확인했다. 또한, 본 연구 결과는 PEDV 확산 예방을 위한 백신 프로그램 설계에 도움이 될

클로스트리듐 디피실(Clostridium difficile, 이하 디피실균)은 신생자돈에서 장염(설사)을 일으킬 수 있으며, 병에 걸린 돼지와 건강한 돼지 모두에서 분리되고 있다. 돼지가 배출하는 디피실균은 인간에게 인수공통전염병을 전파할 수 있는 잠재적 원인이다. 본 연구의 목적은 국내 최초로 돼지의 일령 및 건강 상태와 관련하여 디피실균의 유병률과 유전자형을 특성화하는 것이다. 돼지 910두의 분변 샘플을 채취하여 디피실균의 존재 여부를 분석했다. 그 결과 총 176개(19.3%)의 디피실 균주가 분리되었다. 설사 샘플(30.4%)에서 비설사 샘플(13.3%)보다 유의하게 높은 유병률(p <0.01)을 보였다. 유병률은 설사 포유자돈(53.6%)에서 가장 높았고, 설사 모돈(40.0%), 비설사 포유자돈(34.0%)이 그 뒤를 이었다. 153개 분리주(A+B+CDT+, 86.9%)에서 독소 유전자인 tcdA, tcdB, cdtA, cdtB가 모두 검출되었다. 또한 대부분의 독성 균주(86.5%)는 돼지와 사람 모두에서 중요한 병원체인 PCR 리보타입 078로 확인되었다. 이러한 결과는 디피실균이 국내 신생자돈 설사를 일으키는 주요 원인 병원체임을 시
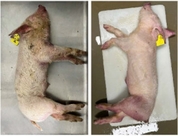
'PRRS바이러스(PRRSV)'는 전 세계적으로 유행하는 고비용 돼지 아테리바이러스(arterivirus)로, 유전적 및 항원적 변이가 광범위하여 새로운 병원성 균주의 출현이 빈번하여 PRRSV 방제를 어렵게 한다. 최근 NADC30 유사(1C, L1C 계통) 및 NADC34 유사(1A, L1A 계통) PRRSV 균주가 한국 본토에서 널리 확산되며, 전국적인 PRRSV 발생의 주요 유행 균주로 자리 잡았다. 이는 한국 양돈산업에 큰 우려를 불러일으켰다. NADC30 및 NADC34 유사 바이러스의 유전형 및 병원형 변이는 미국과 중국에서 연구되었지만, 유전체 및 생물학적 특성은 한국에서 거의 연구되지 않았다. 본 연구에서는 높은 자돈 폐사율을 보이는 백신 접종 돈군에서 NADC34 유사 GNU-2353 및 NADC30 유사 GNU-2377 균주를 독립적으로 분리하였다. 전장 유전체 시퀀싱 및 계통학적 분석 결과, GNU-2353과 GNU-2377은 각각 L1A(NADC34 유사) 및 L1C(NADC30 유사)에 속하는 것으로 확인되었다. 해당 계통을 대표하는 균주와 높은 유전체 상동성을 공유하고, nsp2 코딩 영역에서 각각 100개 아미노산 연속 결실 및
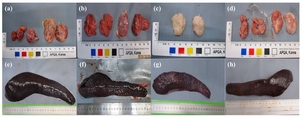
ASF는 돼지에 영향을 미치는 치명적인 전염병이다. 본 연구는 최초의 한국 'ASF 바이러스(ASFV)' 분리주(Korea/Pig/Paju1/2019)를 사용하여 4가지 경로(근육, 구강, 비강, 접촉)를 통해 접종한 돼지에서 각각의 질병 경과를 비교했다. 바이러스 공격 실험에서 근육 접종(IM) 그룹 돼지에게는 '103 HAD50' 1ml을 주사로, '구강 내(IO)' 및 '비강 내(IN)' 그룹 돼지에게는 각각 '106 HAD50' 1ml를 입 또는 콧구멍을 통해 투여하였다. '직접 접촉(DC)' 그룹의 경우 비감염 돼지와 IM 그룹 돼지를 돈방에 함께 수용했다. 연구 결과 IO, IN 및 IM 접종 돼지는 유사한 질병 경과를 보였지만 DC 돼지는 7일 잠복기 후에 비슷한 ASF 증상을 보였다. 가장 흔한 감염 경로 중 하나인 DC 경로의 질병 경과는 IO 및 IN 경로와 유의미한 차이가 없었다. IM 및 DC 그룹은 발열 및 림프절과 비장의 출혈성 병변의 중증도 측면에서 차이를 보였다. 이는 초기 백신 개발 시험에 적합한 IM 경로가 감염 초기 단계를 포함한 ASFV 감염 기전을 연구하는 데 적합하지 않음을 시사한다. 또한, 지정된 용량의 IO 및 IN