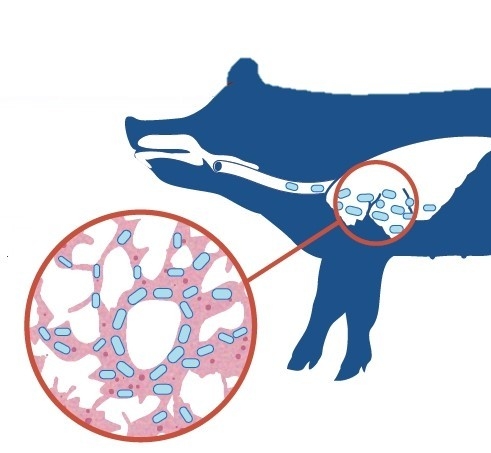
극한 스트레스 조건에서도 생존하는 흉막폐렴균
흉막폐렴균은 숙주의 면역체계가 유도하는 산화스트레스, 항균, 혐기성조건, 양분의 부족과 같은 악조건에서도 '바이오필름(Biofilm)'을 형성하여 숙주 내 집락화 및 지속적인 생존이 가능하다.
'바이오필름'은 세포 외 중합체 매트릭스로, 비생물적 성질의 세균 세포를 자동으로 응집, 보호, 부착시키는 것을 돕는 역할을 한다. 이런 상태에서 흉막폐렴균은 최소한의 영양소만을 요구하며, 항균제를 포함한 화학적인 스트레스 요인에 대한 민감도가 최소화되어 생존력이 극대화되는 절대적인 동면 상태가 된다. 바이오필름은 주어진 환경조건에 따라 가역적으로 조절되는데, 이는 흉막폐렴균이 환경 조건에 따라 언제든지 다시 증식되고 독소를 생산하여 농장에 큰 문제를 일으킬 수도 있다는 것을 의미한다.
흉막폐렴, 백신 접종으로 보균돈으로부터의 전파를 차단하자
위에서 살펴본 바와 같이 흉막폐렴균은 한 번 농장에 감염되면 그 생존력이 굉장히 강해서 박멸하기가 쉽지 않다. 그래서 보균돈을 통한 지속적인 전파의 차단이 무엇보다 중요하다.
흉막폐렴균은 육성 비육돈에서 PRDC를 일으키는 주요 병원체 중 하나이다. PRDC에 기여하는 다른 병원체에는 써코바이러스(PCV2), 마이코플라자마 하이오뉴모니아(M.hyo), 돼지 인플루엔자(SIV), PRRS, 연쇄상구균, 헤모필러스 파라수이스(글래서씨병), 파스튜렐라 멀토시다(PM)등이 있다.
호흡기에 형성된 흉막폐렴균 집락은 그 크기가 아주 작아도 피해를 유발한다. 흉막폐렴은 흉막폐렴균 집락의 개수, 숙주의 면역상태, 일령 그리고 어떤 Apx(외독소)가 발현되는지에 따라서 심급성 감염부터 병이 오랜 기간 지속되는 만성형까지 다양한 임상 형태를 보인다.
가장 잘 알려진 흉막폐렴의 증상은, 심급성형과 급성형에서의 심한 부종, 출혈, 괴사, 섬유성 흉막염을 특징으로 하는 '섬유소-출혈성 기관지폐렴'이다. 이것은 폐 병리학적으로는 Apx 외독소와 LPS 자극에 의해 활성화된 폐 대식세포에 의해 독성 산소 대사물과 염증매개체의 방출에 의해서 발생한다.
준임상적 감염이 되면, 보균돈이 될 가능성이 있다. 보균돈은 편도선에만 흉막폐렴이 감염된 경우로 세균이 숙주의 후천면역을 피하여, 혈청학적으로는 음성을 유지하는 감염상태를 말한다. 다른 개체에 대한 전파력 또한 가지고 있다.
만성형은 급성, 아급성 또는 준임상적 감염의 결과로 나타날 수 있다. 유착, 섬유성 흉막염, 괴사성 분리증 또는 섬유성 결합조직으로 덮인 농양을 보이고, 호흡운동에서의 통증과 폐기능 저하를 초래한다. 비육돈의 출하일령까지 증상이 지속된다. 만성형의 돼지도 준임상적 감염의 경우처럼 보균돈이 되어 아무 증상 없이 편도선에 흉막폐렴균을 가지고 있을 수도 있으며, 다른 개체에 흉막폐렴을 전파시키는 것이 가능하다. 다른 개체가 무증상 보균돈과 직간접적으로 접촉하게 되면, 흉막폐렴의 선행 감염과 바이러스와의 복합감염이 있고 없음 등에 따라 흉막폐렴 이환율과 폐사율이 급증할 수 있다. 보균돈에 의한 이환율과 폐사율을 효과적으로 컨트롤 하기 위해선 흉막폐렴 백신이 필수적이다.
흉막폐렴 주요 촉발요인 중 하나인 ‘스트레스 컨트롤’도 매우 중요하다
돼지의 호흡기 질환과 관련된 위험요소에는 주로 후보돈 도입방식, 농장 형태와 규모, 사육시설, 사육밀도, 환기량, 공기의 질 온도와 온도편차, 직간접 접촉, 공기전파의 경우 에어로졸 농도, 차단방역과 위생도 등이 있다. 이것들을 감안하여 예방대책을 세워야 한다.
흉막폐렴은 특히, 급성 스트레스 요인을 줄이기 위해서 세밀한 사양관리가 필요하다. 스트레스 호르몬인 에피네프린과 노르에피네프린은 독성인자가 코딩된 부분을 포함한 흉막폐렴균 유전자의 발현을 변화시키는 것으로 알려져 있기 때문이다.
이와 더불어 환경변화와 흉막폐렴 발생 사이의 연관성도 연구에서 확인되었는데, 이것은 외부의 요인이 돼지의 면역체계와 항상성 등을 변화시켜 돼지와 흉막폐렴균 간의 상호작용에 영향을 주었다는 것을 의미한다.
다음 편에서 계속…
References:
1) Langford PR, Stringer OW, Li Y, Bossé JT. Application of the MISTEACHING(S) disease susceptibility framework to Actinobacillus pleuropneumoniae to identify research gaps: an exemplar of a veterinary pathogen. Anim Health Res Rev. 2021;19:1-16. doi: 10.1017/S1466252321000074. PMID: 34275511. 2) Nahar N, Turni C, Tram G, Blackall PJ, Atack JM. Actinobacillus pleuropneumoniae: The molecular determinants of virulence and pathogenesis. Adv Microb Physiol. 2021;78:179-216. doi: 10.1016/bs.ampbs.2020.12.001. PMID: 34147185. 3) Opriessnig T, Giménez-Lirola LG, Halbur PG. Polymicrobial respiratory disease in pigs. Anim Health Res Rev. 2011;12(2):133-48. doi: 10.1017/S1466252311000120. PMID: 22152290. 4) Qi W, Zhu R, Bao C, Xiao J, Liu B, Sun M, Feng X, Gu J, Li Y, Lei L. Porcine circovirus type 2 promotes Actinobacillus pleuropneumoniae survival during coinfection of porcine alveolar macrophages by inhibiting ROS production. Vet Microbiol. 2019;233:93-101. doi: 10.1016/j.vetmic.2019.04.028. PMID: 31176418. 5) Pomorska-Mól M, Dors A, Kwit K, Kowalczyk A, Stasiak E, Pejsak Z. Kinetics of single and dual infection of pigs with swine influenza virus and Actinobacillus pleuropneumoniae. Vet Microbiol. 2017;201:113-120. doi: 10.1016/j.vetmic.2017.01.011. PMID: 28284596. 6) Pol JM, van Leengoed LA, Stockhofe N, Kok G and Wensvoort G. Dual infections of PRRSV/influenza or PRRSV/Actinobacillus pleuropneumoniae in the respiratory tract. Veterinary Microbiology 1997;55:259–264. 7a) Velazquez E, Gale C. Positive effects of vaccination against Actinobacillus pleuropneumonia (A.p.) and optimized co-infection vaccination measured on Ap related lesions. Proc. EAPHM 2019;BBD-PP-37:151. 7b) Velazquez E, Gale C. Efficacy in Reduction of Actinobacillus Pleuropneumoniae Related Lung Lesions by Vaccination Against Actinobacillus Pleuropneumoniae and Optimized Vaccination Against Mycoplasma Hyopneumoniae Co-infection. Proc. APVS 2019;IMM-17:127
※ 위 기고 내용과 관련하여 궁금하신 사항은 세바코리아 (070. 8277. 4747 / 카카오톡채널: 세바코리아 / cevakorea@ceva.com)로 문의주시기 바랍니다.