본 원고는 지난 2019년 8월 서울에서 개최한 2019 아시아 양돈수의사대회(Asian Pig Veterinary Society Congress, APVS 2019)에서 대만 National Chung Hsing University의 Maw-Sheng Chien 교수가 Keynote lecture로 발표한 초록, 돼지 열병 백신 접종의 효과 및 영향(The Efficacy and Impact of Classical Swine Fever Vaccination) 내용을 번역한 내용이다.
돼지열병(Classic swine fever, 이하 CSF)은 전세계적으로 돼지에서 가장 치명적인 바이러스성 해외악성가축전염병 중 하나이다. CSF는 Flaviviridae family, Pestivirus genus에 속하는 외피 단일 가닥 RNA 바이러스인 CSF 바이러스에 의해 발생한다.
CSF의 발생은 즉각적으로 양돈 산업에 큰 경제적 손실을 초래할 수 있으며, CSF 유행(Epidemic) 지역에서는 질병의 통제 및 박멸을 위해 수많은 노력이 요구될 수 있다. 따라서, 세계동물보건기구(이하 OIE)는 CSF를 신고대상 질병 목록에 등재해 놓았다.
현재 많은 국가들에서 강화된 장기 모니터링을 통한 대규모 감시 프로그램과 가장 강력한 살처분 정책을 적용함으로써 CSF를 성공적으로 근절했다[1]. 그러나, OIE에 따르면 CSF는 여전히 전세계 곳곳의 멧돼지 및 집돼지에서 산발적으로 발병하고 있다.
비록 대부분의 CSF 청정 국가에서 백신 접종 없는 살처분 정책이 시행되었지만, 유행성으로 발병할 경우에는 질병의 전파를 차단하고 막대한 비용 및 사회적 손실을 최소화하기 위해 긴급하게 예방적 Rim vaccination(링백신)을 허용한다[2,3].
일본은 10년 동안 성공적인 박멸 프로그램을 실시하여 2015년 OIE 공식 발표에 따라 CSF 청정 국가 목록에 추가되었으나, 이전에 CSF가 발생하지 않았던 지역의 멧돼지에서 지속적으로 재발하고 있음이 2019년 OIE에 보고되었다. 이러한 상황은 CSF가 실제로 전염성이 강하고 까다로운 바이러스라서 농장 및 야외에 장기간 존재해 왔음을 증명한다.
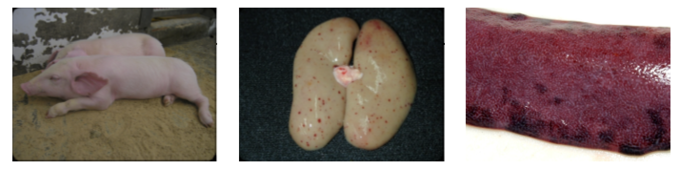
CSF는 출혈성, 전신 다발성 및 임파절 손상 바이러스성 질병이기 때문에 감염된 돼지는 급성, 아급성, 만성, 지연 발병으로 나타나거나, 준임상형으로 유지될 수 있으며 감염 후 다양한 염증 반응 진행 및 병리학적 패턴에 따라 지속감염 상태(persistent status)로 발전할 수 있다[4, 5].
CSF의 임상 증상 또한 다양하며 바이러스의 병원성, 감염된 돼지의 나이 또는 면역 상태에 따라 결정된다. 강독 및 중간독 바이러스는 일반적으로 급성 또는 아급성 형태로 발현되는 반면, 병원성이 약하거나, 부적절한 백신 접종으로 인해 면역이 결핍(Immunodeficiency)된 경우에는 대부분 만성형으로 진행된다.
실제로, 준임상형 또는 지속 감염은 불명확하고 비정형적인 임상증상을 유발하여, 토착화(Endemic) 지역에서 질병 진단 및 통제에 있어 어려움을 증가시킨다.
세포 배양 또는 토끼에서 생산한 약독화 생독 백신(이하 생독 백신)이 1960년대에 개발되어, CSF가 토착화된 아시아 국가들에서는 질병 통제 수단으로 생독 백신을 수십 년 동안 널리 적용하고 있다. 이처럼 상업적으로 이용 가능한 생독 백신은 체액성 및 세포성 면역 반응을 모두 유도할 수 있고, 백신 접종한 돼지에서 우수한 방어 면역을 유도할 수 있다.
중화 항체(Neutralizing Antibody, NA)는 백신 접종 후 5일째부터 유도 가능하며, NA 역가의 평균 혈청 전환율이 32배 이상인 경우 유행 지역에서 발병을 차단하기 위해 개체별 방어 표준 및 돈군의 적절한 지표로 간주한다.
생독 백신은 매우 효과적이지만, 모체이행항체(MDA)의 간섭이 심하고, MDA의 개체별 편차가 커서 자돈에서 백신 접종 일령을 효율적으로 수립하기 어렵고, 임신 모돈과 허약한 자돈에 백신 접종 시 부작용이 발생할 수 있다. 또한, PRRS, PCV2와 같은 다양한 병원성 바이러스 및 세균과 함께 복합감염될 경우 백신의 효과가 영향을 받는다. 게다가, 생독 백신의 또다른 단점은 감염된 동물과 백신 접종한 동물의 감별 진단(Differentiating Infected from Vaccinated Animals, DIVA)이 어렵다는 점이다[4, 6].
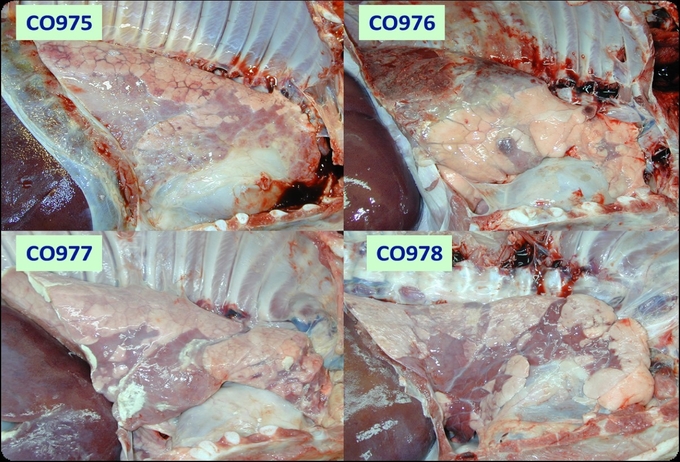
CSF 바이러스는 단 한가지의 혈청형만 존재하며, Pestivirus의 주요 외피 단백질인 E2 당단백질이 가장 강력한 면역원인 것으로 입증되었기 때문에, E2 당단백질을 항원으로 사용하고 Erns 당단백질을 DIVA 마커로 사용하는 백신 개발 전략은 생독 백신의 주요 제약 조건을 극복했다.
곤충 세포주, 유충 및 누에로부터 각각 Baculovirus에 의해 발현시키는 다양한 E2 유전자 재조합 마커 백신(이하 E2 백신)들이 있다. 최근에는 효모(Pichia pastoris) 발현 시스템이 성공적으로 개발되었다.
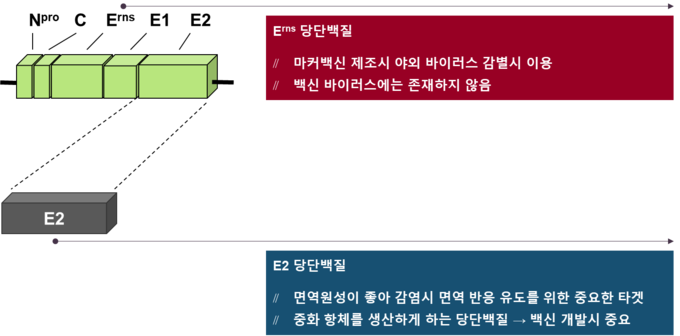
Baculovirus 및 효모 발현 시스템에서 발현한 E2 백신을 접종한 돼지에서 치사량 수준의 CSF 바이러스 공격접종시 우수한 방어 면역 반응을 유도하며, 공격 접종 돈군에 백신 비접종 돈군을 동거시킨 후에도 수평 감염을 차단한다는 다양한 연구들이 진행됐다[4,7,8]. E2 백신의 안전성 및 효능이 확인되었음에도 생독 백신과 비교하여 발현 안정성 및 생산 비용과 관련하여 일부 제한이 나타났다[1,9].
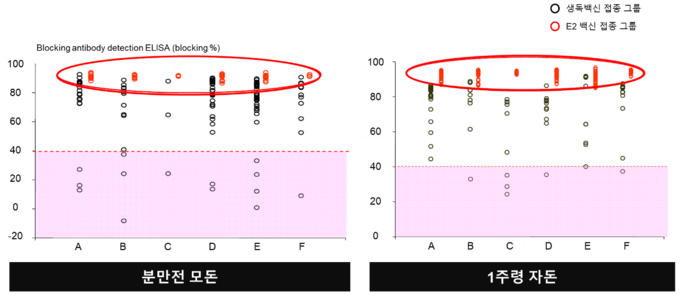
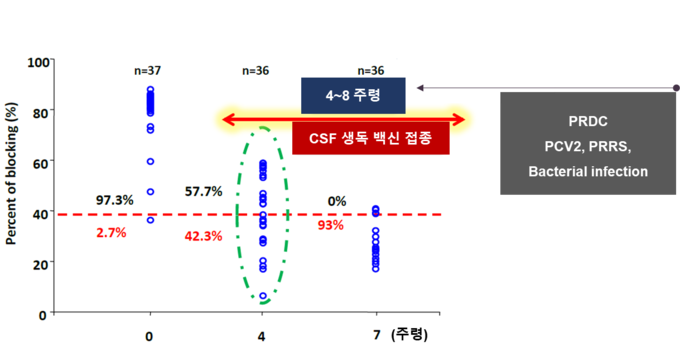
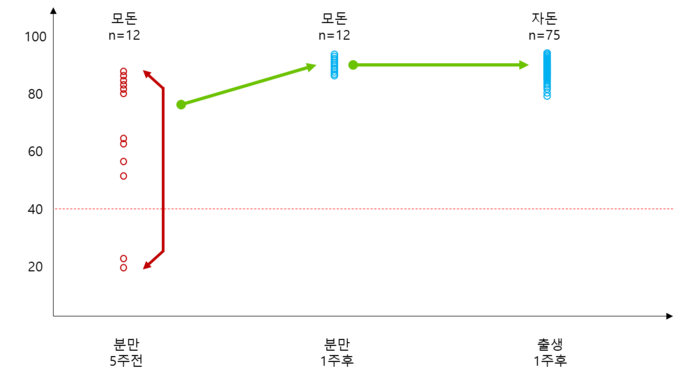
또한, 쌀, 옥수수, 밀, 토마토 또는 감자를 포함한 형질 전환 식물을 사용하여 경구를 통해 동물 백신 항원을 발현시키는 몇몇 연구가 수행되었다. 형질 전환 쌀에서 재조합 E2 단백질의 발현이 수행되었고 마우스 및 돼지에서의 경구 투여 후 유도된 면역 반응이 확인되었다[10].
또한, 새로운 세대의 재조합 생독 마커 백신이 조사되었는데, 이 생독 백신은 BVDV(Bovine viral diarrhea virus, 소 바이러스성 설사병 바이러스)의 주 면역원을 운반하는 chimera pestivirus(CP7 E2 alf)를 기반으로 한다. 동물 실험 결과에 따르면, 본 백신은 어린 돼지에 대한 근육 및 경구 경로 모두에 적용할 수 있는 생독 백신 균주이며, 모체이행항체(MDA)가 존재하는 자돈에 접종 시 기존 생독 백신에 비해 MDA 간섭이 덜하다[11,12].
그러나 백신 접종된 돼지에서 유도된 체액성 면역 반응은 혈청학적 교차 반응이 가능하기 때문에 DIVA로서 완전히 감별되지는 않는다[1]. 그럼에도 불구하고, 생독 키메라 백신을 개발하는데 있어 주요 제한 요인은 효능 또는 DIVA의 한계보다는, 필드에 적용하기전 국가별 유전자 변형 물질(GMO) 규정 및 백신 등록 절차에 관한 문제인 것으로 받아들여지고 있다.
최근 여러 연구에서 PRRSV 감염이 돼지에서 생독 백신의 효능을 손상시키는 주요 위험 요소 중 하나라는 것이 입증되었다. PRRSV 백신과 CSF 백신을 동시에 또는 짧은 간격으로 접종할 때 CSFV 백신 접종의 면역 반응을 현저하게 감소시킬 수 있다[13].
또한, 최근 연구들은 PCV2 감염이 돼지에서 면역 저하 특성(immunocompromised properties)을 나타내며 CSF 백신 접종 전후에 PCV2 감염이 백신 효능을 방해할 수 있음을 보여주었다[14]. 게다가, PRRSV 및 PCV2의 순차적 또는 동시 감염은 CSF 백신의 효능에 크게 영향을 준다[5,15].
하지만, 생독 CSFV 백신의 영향과 연관된 동시 감염에 대한 대부분의 연구들은 SPF 동물 모델에서의 PRRSV에 중점을 두고 수행되었으며, 실제 농장 임상 적용에서 강조된 연구는 거의 없다.
PCV2 백신이 수년간 현장에서 널리 사용되어 왔으며 백신을 접종한 돼지에서 PCVAD(돼지 써코바이러스 연관 질병)의 임상 증상을 최소화하는데 우수한 효능을 보여주지만, 유도된 면역력이 백신 접종 돈군에서 PCV2 침입으로부터 돼지를 완전히 막을 수는 없다.
PCV2에 준임상형으로 감염된 돼지(subclinical infected pigs, PCV2-SI)에서 이러한 누출(leaky) 상태는 일반적으로 무증상으로 보이거나 농장에서 건강한 돼지로 인식된다. PCV2-SI는 일반 농장들에 토착화되었기 때문에 생독 CSF 백신에 대한 MDA 간섭과 PCVAD의 잠재적 영향과 관련된 위험은 PCV2-SI 또는 PCV2에 의한 전신성 질병(PCV2-systemic disease, PCV2-SD)이 문제되는 돼지 농장에서 집중적인 평가가 필요하다.
백신 효능의 평가는 동물 실험에서 혈청 항체 역가, 바이러스혈증 수준, 인공감염후 임상 지수 및 병리학적 변화를 포함하는 몇 가지 기준을 포함하지만, 일반 돼지 농장에서 고려해야 할 개체별 편차 및 예측할 수 없는 몇 가지 요소들이 있다.
번역을 마치며
CSF E2 마커 백신은 궁극적으로 CSF 바이러스가 없는 청정한 상태를 만들기 위해 사용하는 백신이다. 외부 바이러스 자극이 없는 순수한(naive) 상태에서 E2 백신을 사용하는 것은 만약의 경우에 대비한 방어력을 확보하기 위한 목적도 있지만 외부 바이러스 유입에 대한 모니터링 효과도 중요하다.
E2 백신의 또다른 장점은 야외 바이러스와 백신 바이러스를 구분할 수 있고, 발병을 일으킬 정도로 많은 양의 바이러스가 아닌 낮은 수준의 바이러스라도 농장 내로 바이러스가 유입된 경우, 혈청 프로파일을 통해 CSF 음성 농장에 야외 바이러스가 언제 들어왔는지, 바이러스 유입 시점 이전에 충분한 면역 수준까지 도달하기 시키기 위해서 농장의 백신 프로그램을 어떻게 조정해야 할지 등에 대한 정보를 얻을 수 있다.
CSF에 오염된 농장의 경우 E2 백신을 지속적으로 접종함으로써 감염된 돼지(특히 모돈)들의 바이러스 배설량 및 기간을 최소화할 수 있다. 또한, 환경 내 잔존하는 바이러스까지 제거하기 위해 소독을 통한 방역 프로그램도 철저하게 시행해야 한다.
CSF가 만성적으로 오염된 농장은 특히 면역 억제성 질병인 PRRS, PCV2 등과 복합 감염되어 돈군의 건강 상태를 더 악화시키기 때문에, 본 질병들에 대한 해결도 병행해야 한다.
참고문헌
[1] H.S.Yoo, Prospects of Plant-Based Vaccines in Keynote Lectures, August 25~28, 2019 Korea 37 Veterinary Medicine, Springer International Publishing, 2018.
[2] L.G.Holinka, I.Fernandez-Sainz, B.Sanford, V.O’Donnell, D.P.Gladue, J.Carlson, Z.Lu, G.R.Risatti, M.V.Borca, Virology 471 (2014) 13–18.
[3] S.Blome, C.Staubach, J.Henke, J.Carlson, M.Beer, Viruses (2017).
[4] Y.L.Huang, M.C.Deng, F.I.Wang, C.C.Huang, C.Y.Chang, Virus Res. 179 (2014) 1–11.
[5] S.I.Lim, H.Y.Jeoung, B.Kim, J. youngSong, J.Kim, H.Y.Kim, I.S.Cho, G.H.Woo, J.B.Lee, D.J.An, Vet.
Microbiol. 193 (2016) 36–41.
[6] S.Suradhat, S.Damrongwatanapokin, R.Thanawongnuwech, Vet. Microbiol. 119 (2007) 1–9.
[7] K.S.Lee, M.R.Sohn, B.Y.Kim, Y.M.Choo, S.D.Woo, S.S.Yoo, Y.H.Je, J.Y.Choi, J.Y.Roh, H.N.Koo, B.R.Jin, Mol. Biotechnol. 50 (2012) 211–220.
[8] R.Madera, W.Gong, L.Wang, Y.Burakova, K.Lleellish, A.Galliher-Beckley, J.Nietfeld, J.Henningson, K.Jia, P.Li, J.Bai, J.Schlup, S.McVey, C.Tu, J.Shi, BMC Vet. Res. 12 (2016) 1–10.
[9] S.Blome, C.Moß, I.Reimann, P.König, M.Beer, Vet. Microbiol. 206 (2017) 10–20.
[10] M.Jung, Y.J.Shin, J.Kim, S.BinCha, W.J.Lee, M.K.Shin, S.W.Shin, M.S.Yang, Y.S.Jang, T.H.Kwon, H.S.Yoo, Arch. Virol. 159 (2014) 3219–3230.
[11] P.L.Eblé, S.Quak, Y.Geurts, H.W.M.Moonen-Leusen, W.L.A.Loeffen, Vet. Microbiol. 174 (2014) 27–38.
[12] S.Blome, C.Gabriel, S.Schmeiser, D.Meyer, A.Meindl-Böhmer, F.Koenen, M.Beer, Vet. Microbiol. 169 (2014) 8–17.
[13] X.Wang, G.Mu, R.Dang, Z.Yang, Vet. Microbiol. 197 (2016) 68–71.
[14] Y.L.Huang, V.Pang, C.M.Lin, Y.C.Tsai, M.Y.Chia, M.C.Deng, C.Y.Chang, C.R.Jeng, Vet. Res. (2011).
[15] N.Chen, Y.Huang, M.Ye, S.Li, Y.Xiao, B.Cui, J.Zhu, Infect. Genet. Evol. (2019).